Линии по производству ветеринарных препаратов в китае (сертификация gmp)
Когда речь заходит о GMP-сертификации в Китае, многие ошибочно полагают, что это просто ?ещё одна бумажка?. На деле же — это система, выстраданная на каждом этапе: от проектирования чистых зон до валидации моечных процессов. Помню, как на одном из объектов в Шаньси пришлось трижды переделывать разводку сжатого воздуха — инспектор выявил риск перекрёстного загрязнения через конденсат. Именно такие нюансы определяют, будет ли производство работать или станет очередным ?складом нереализованных амбиций?.
Ключевые сложности при адаптации GMP для ветеринарии
С ветеринарными препаратами есть специфика: например, требования к чистоте для антибиотиков и витаминов разнятся, но на одном производстве их часто совмещают. В том же АО Шаньси Цзиньфукан Биофармацевтика изначально заложили раздельные технологические потоки для твёрдых и жидких форм, но пришлось дополнительно зонировать линии по классам чистоты — китайские стандарты здесь жёстче европейских. Кстати, их сайт sxjfk.ru содержит технические параметры, но живого опыта там не найдёшь — его мы нарабатывали методом проб и ошибок.
Особенно проблемными оказались валидации моечных процессов. Для оборудования, контактирующего с порошковыми субстанциями, стандартные протоколы не подходили — остаточные следы в 2-3 микрона могли привести к браку партии. Пришлось разрабатывать кастомные методики с использованием люминесцентных маркеров. Это тот случай, когда теория GMP расходится с практикой: в гайдлайнах пишут ?обеспечьте чистоту?, но как именно — решает производитель.
Ещё один момент — сырьё. Китайские поставщики активных фармсубстанций часто меняют технологию синтеза, что влияет на параметры валидации. Мы как-то получили партию окситетрациклина с повышенной электропроводностью — пришлось экстренно корректировать режим стерилизации. Такие ситуации в отчётах не отражаются, но именно они определяют устойчивость производства.
Региональные особенности провинции Шаньси
В Юньчэне, где расположен Цзиньфукан, климат добавляет сложностей: высокая влажность летом требует постоянного мониторинга систем вентиляции. При проектировании их завода в индустриальной зоне уезда Руйчэн не учли сезонные колебания — в первый же июль пришлось устанавливать дополнительные осушители. Местные власти, впрочем, идут навстречу: налоговые льготы для GMP-сертифицированных производств компенсируют часть затрат.
Инфраструктура — отдельная тема. Логистика из района Юнлэ 226 была изначально слабым звеном: доставка сырья задерживалась, что срывало график валидаций. Пришлось строить собственный складской терминал с климат-контролем. Инвестиции в 50 миллионов юаней, о которых упоминается в описании компании, включали и эти непредвиденные расходы.
Любопытно, что местные кадры оказались восприимчивее к стандартам GMP, чем мы ожидали. Технологи с опытом работы в фармацевтике для людей быстро адаптировались к ветеринарным нормам — видимо, сказывается наследие региона как одного из центров традиционной китайской медицины.
Технологические ловушки при масштабировании
Планируя годовое производство на 60 миллионов юаней, многие недооценивают риски перехода от опытных партий к серийным. Например, на линиях для кормовых добавок мы столкнулись с проблемой сегрегации компонентов при увеличении объёма смесителя с 50 до 500 кг. Пришлось привлекать немецких специалистов по рифлёным барабанам — китайские аналоги не обеспечивали гомогенность.
Система очистки воды — ещё больная тема. В производстве ветеринарных препаратов требования к воде ниже, чем для медицинских, но для инъекционных форм нужна WFI (вода для инъекций). Получение её методом обратного осмоса вместо дистилляции — распространённая ошибка. Мы наступили на эти грабли при запуске линии для витаминных комплексов: экономия 200 тысяч юаней на оборудовании обернулась повторной сертификацией.
Автоматизация — палка о двух концах. Siemens-совместимые контроллеры, которые ставили на линии в Шаньси, выдавали сбои при высокой запылённости. Перешли на японские решения с классом защиты IP65, но их интеграция с местным ПО заняла полгода. Это к вопросу о том, почему ?готовые? GMP-решения из каталогов часто не работают.
Валидация как непрерывный процесс
Многие воспринимают валидацию как разовое мероприятие ?под сертификат?. В реальности, например, для стерилизационных автоклавов приходится проводить её ежегодно, а при смене типа упаковки — внепланово. В Цзиньфукан мы разработали цикл из 14 протоколов, где каждый этап — от калибровки термопар до тестов на проникновение пара — документировался с привязкой к конкретным операторам.
Особенно сложной оказалась валидация моечных машин для многоцелевого оборудования. Стандартные методы с использованием бензойной кислоты не подходили для линий, где попеременно производились антибиотики и пробиотики. Применили методологию на основе ATP-биолюминесценции — дорого, но позволило исключить риски перекрёстной контаминации.
Любопытный нюанс: китайские инспекторы обращают особое внимание на валидацию компьютерных систем. Для логистического модуля ERP пришлось доказывать соответствие 21 CFR Part 11, хотя речь шла о ветеринарных препаратах. Это показывает, как локальные требования порой превышают международные.
Экономика GMP: скрытые затраты и компромиссы
При общих инвестициях в 50 миллионов юаней около 15% ушло на решения, не предписанные прямыми нормами GMP. Например, система мониторинга частиц в реальном времени в чистых зонах — формально можно обойтись ручными замерами, но для страховки от внеплановых проверок лучше иметь постоянный контроль.
Себестоимость сильно зависит от локализации. Китайское оборудование для лиофилизации в 3 раза дешевле европейского, но его валидация требует на 40% больше времени. Для стартапа это может быть критично, но для такого предприятия как АО Шаньси Цзиньфукан Биофармацевтика с их объёмами игра стоила свеч — взяли немецкие тоннельные сушилки, но для вспомогательных операций использовали местные аналоги.
Окупаемость GMP-проектов в ветеринарии — 5-7 лет против 3-4 в ?человеческой? фармацевтике. Но есть нюанс: сертификация открывает экспорт в страны ЕАЭС, где маржинальность выше. Те же препараты для птицеводства, выпущенные на мощностях в Юньчэне, поставляются теперь в Казахстан и Беларусь — там доверяют китайскому GMP при наличии грамотного досье.
Перспективы и локальные тренды
В Шаньси сейчас наблюдается сдвиг в сторону премиальных препаратов — например, для аквакультуры или домашних животных. Это требует модернизации линий: если для птицеводческих антибиотиков достаточно класса D, то для иммуномодуляторов для рыб уже нужен класс C. Линии по производству ветеринарных препаратов в Китае постепенно переходят от ?одних настроек на всё? к гибким конфигурациям.
Интересно, что местные власти начали субсидировать внедрение непрерывного мониторинга. В том же уезде Руйчэн дают до 20% компенсации на системы отслеживания параметров в реальном времени — видимо, понимают, что это повышает шансы на экспорт.
Лично я считаю, что будущее за гибридными моделями: GMP-ядро для критичных продуктов + упрощённые линии для массовых добавок. Как раз подход, который начали применять в Цзиньфукан на их площади в 21 199 м2 — разделили производство на модули с разным уровнем контроля. Практично, хотя и не идеально с точки зрения ?чистоты? стандартов.
Соответствующая продукция
Соответствующая продукция
Самые продаваемые продукты
Самые продаваемые продукты-
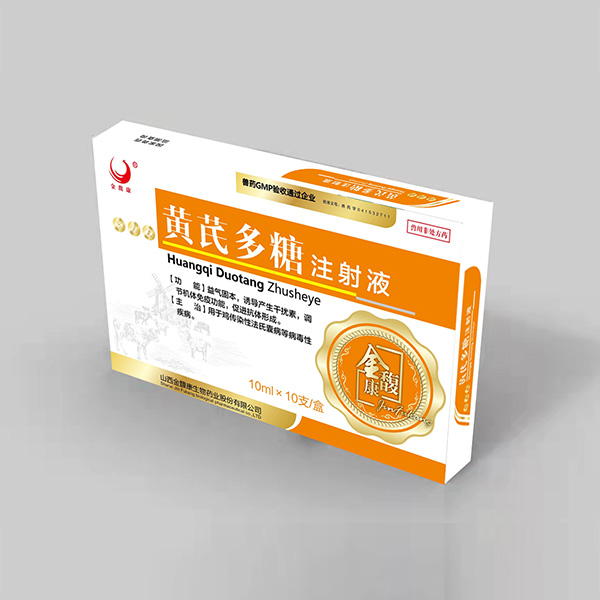
 Инъекция сложного аминобилина
Инъекция сложного аминобилина -
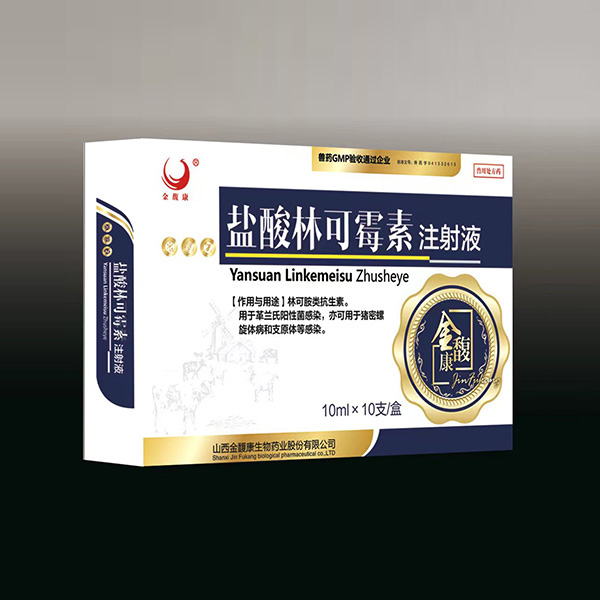 Инъекция линкомицина гидрохлорида
Инъекция линкомицина гидрохлорида -
 Таблетки Альбендазола с Ивермектином
Таблетки Альбендазола с Ивермектином -
 Порошок Махин шиган
Порошок Махин шиган -
 Гранулы альбендазола
Гранулы альбендазола -
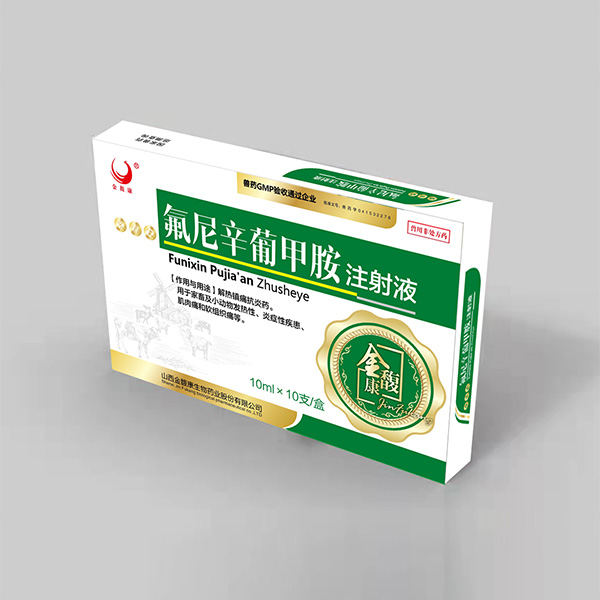 Инъекции глюкометиламина Флуниксина
Инъекции глюкометиламина Флуниксина -
 Цефоперазон сульбактам натрия для инъекций
Цефоперазон сульбактам натрия для инъекций -
 Пероральная жидкость Яншухуа
Пероральная жидкость Яншухуа -
 Гранулы для печени и желчного пузыря
Гранулы для печени и желчного пузыря -
 Инъекция рыбьего золота
Инъекция рыбьего золота -
 Панцин гранулы
Панцин гранулы -
 Порошок Цзинфан байду
Порошок Цзинфан байду
Связанный поиск
Связанный поиск- Поставщики утерит (ветеринарное лечение)
- Зарегистрированные ветеринарные препараты
- Ведущий покупатель индивидуальных ветеринарных препаратов
- Цены на микоплазменная пневмония (ветеринарное лечение)
- Печеночные двуустки (ветеринарное средство от насекомых)
- Крупнейшие покупатели простуды и лихорадки (ветеринарные травяные препараты)
- Основные покупатели ветеринарных препаратов (условия рынка)
- Производители ветряно-холодных простуд (животные)
- Китайская инъекция shuanghuanglian
- Поставщики ветеринарных методов (применение на животных)